уравнение реакции сульфата железа с азотной кислотой
- Droog_Andrey
- Сообщения: 2695
- Зарегистрирован: Сб сен 29, 2007 8:29 pm
- Контактная информация:
Re: уравнение реакции сульфата железа с азотной кислотой
Двухвалентное железо в растворе действительно окисляется до трёхвалентного нитратами. В кислой среде помогает H+, делая из спокойного нитрата злую молекулу азотки, а в щелочной среде помогает OH¯, делая из слабого восстановителя Fe2+ сильный FeOH+. В нейтральной среде нитрат-ион может окислить двухвалентное железо при нагревании, т.к. при этом усиливается гидролиз:
9Fe(NO3)2 + 6H2O = 5Fe(NO3)3 + 4Fe(OH)3 + 3NO
Сульфат железа(II) окисляется азоткой по уравнению
3FeSO4 + 4HNO3 = Fe2(SO4)3 + Fe(NO3)3 + NO + 2H2O
Все эти процессы сильно ускоряет кислород воздуха.
9Fe(NO3)2 + 6H2O = 5Fe(NO3)3 + 4Fe(OH)3 + 3NO
Сульфат железа(II) окисляется азоткой по уравнению
3FeSO4 + 4HNO3 = Fe2(SO4)3 + Fe(NO3)3 + NO + 2H2O
Все эти процессы сильно ускоряет кислород воздуха.
2^74207281-1 is prime!
Re: уравнение реакции сульфата железа с азотной кислотой
Avak_Avakyan , коллега, давайте в этой теме обойдемся без обсуждения нюансов системы образования. Если хотите, можем обсудить это в курилке.
Теперь по делу. Стабильность нитрата двухвалентного железа в воде (в отсутствии кислорода) похоже обусловлена низкой степенью гидролиза железа (II). Конкретный справочник мне найти не удалось, к сожалению, но могу направить по ссылке http://www.himikatus.ru/art/demo-exp/0093.php (похоже книга по количественному анализу) Показатель константы гидролиза для ионов двухвалентного железа составляет 9,5 а для трехвалентного железа 2,2. Вы можете поискать значения констант для гидролиза этих ионов и посчитать на сколько кислой будет среда хотя бы в растворах с концентрацией 1 моль/л, что бы попытаться доказать что-то конкретно. Но я могу на основе этих данных сказать, что не будет достаточно (говоря вашим языком) азотной кислоты, что бы мы могли наблюдать заметное окисление в растворе в бескислородных условиях.
Теперь о собственно главной теме обсуждения: окислении двухвалентного железа азоткой. Пожалуй antabu правильно подметил: .
Что мы имеем в остатке? Могу предположить, что при попытке провести реакцию между растворами соли железа (II) и разбавленной азотной кислоты мы не обнаружим никаких органолептически заметных признаков протекания реакции в течении времени разумного по меркам школного пробирочного эксперимента (ну скажем минут 5). При этом не важно будет ли реакция выполняиться с обычной водой (в которой растворён кислород) или под инертной атмосферой. С другой стороны, это вовсе не означает, что окисление железа (II) до железа (III) в это время не происходит!
Кстати, из всего выше написанного следует любопытное предположение: что бы стабилизировать (пусть на небольшое время) раствор нитрата железа (II) в обычной дистиллированной воде его нужно подкислить небольшим (может быть несколько капель на пробирку) количеством разбавленной азотной кислоты.
[ Post made via Android ]
Теперь по делу. Стабильность нитрата двухвалентного железа в воде (в отсутствии кислорода) похоже обусловлена низкой степенью гидролиза железа (II). Конкретный справочник мне найти не удалось, к сожалению, но могу направить по ссылке http://www.himikatus.ru/art/demo-exp/0093.php (похоже книга по количественному анализу) Показатель константы гидролиза для ионов двухвалентного железа составляет 9,5 а для трехвалентного железа 2,2. Вы можете поискать значения констант для гидролиза этих ионов и посчитать на сколько кислой будет среда хотя бы в растворах с концентрацией 1 моль/л, что бы попытаться доказать что-то конкретно. Но я могу на основе этих данных сказать, что не будет достаточно (говоря вашим языком) азотной кислоты, что бы мы могли наблюдать заметное окисление в растворе в бескислородных условиях.
Теперь о собственно главной теме обсуждения: окислении двухвалентного железа азоткой. Пожалуй antabu правильно подметил: .
При более-менее внимательном прочтении статьи о механизме окисления железа (II) нитрат-ионами в кислой среде легко обнаружить что все стадии непосредственного окисления ионов железа достаточно медленные. Для тех кто в аглицком слабоват рекомендую посмотреть на рисунки 1 и 2 (в статье) и вы увидете, что эксперимент продолжался около получаса. Ещё авторы отмечают, что кислород растворённый в воде ингибирует реакцию в целом (снижает наблюдаемую скорость реакции), судя по всему вступая во взаимодействие с оксидами азота. Самое главное для данной темы (говоря о споре с товарищем Avak_Avakyan), что следует из статьи это: нитрат ион в кислой среде окисляет железо (II). Судя по всему низкая скорость окисления двухвалентного железа обусловлена кислой средой. Так Реми во 2-м томе пишет, что окисление железа (II) до железа (III) обусловлено "нарушением окислительных равновесий вызываемых низкой растворимостью окиси железа (III)" (а скорее всего он имеет ввиду гидрат окиси в водной среде, или нечто вроде гидролизованных форм ионов железа три; тут бы конечно оргинал нужно посмотреть, а не русский перевод...). И рекомендует для устойчивости к окислению кислую среду раствора. Коттон и Уилкинсон прямо говорят о том, что в кислых средах окисление железа (II) затруднено по кинетическим причинам, т.к. не образуется гидролизованных форм железа (III). Аналогично пишет и Рипан с Четяну, что в кислых растворах железо (II) более учтойчиво к окислению чем его гидроксид.antabu писал(а):Из практики. Реакция окисления двухвалентного железа азотной кислотой не такая простая. Возможно, наблюдается автокатализ.
Что мы имеем в остатке? Могу предположить, что при попытке провести реакцию между растворами соли железа (II) и разбавленной азотной кислоты мы не обнаружим никаких органолептически заметных признаков протекания реакции в течении времени разумного по меркам школного пробирочного эксперимента (ну скажем минут 5). При этом не важно будет ли реакция выполняиться с обычной водой (в которой растворён кислород) или под инертной атмосферой. С другой стороны, это вовсе не означает, что окисление железа (II) до железа (III) в это время не происходит!
Кстати, из всего выше написанного следует любопытное предположение: что бы стабилизировать (пусть на небольшое время) раствор нитрата железа (II) в обычной дистиллированной воде его нужно подкислить небольшим (может быть несколько капель на пробирку) количеством разбавленной азотной кислоты.
[ Post made via Android ]

Бог даёт лучшее тому, кто оставляет выбор за Ним
- Droog_Andrey
- Сообщения: 2695
- Зарегистрирован: Сб сен 29, 2007 8:29 pm
- Контактная информация:
Re: уравнение реакции сульфата железа с азотной кислотой
Вот это поворот.C10H16 писал(а):авторы отмечают, что кислород растворённый в воде ингибирует реакцию в целом (снижает наблюдаемую скорость реакции), судя по всему вступая во взаимодействие с оксидами азота.
В щелочной и нейтральной среде кислород точно ускоряет процесс. А в кислой, получается, ингибирует. Почему? И причём тут оксиды азота?
2^74207281-1 is prime!
Re: уравнение реакции сульфата железа с азотной кислотой
Droog_Andrey, посмотри статью, которую выложил Гесс в своём сообщении: http://chemport.ru/forum/viewtopic.php? ... 19#p858080 В окислении железа принимает участие NO, со всеми вытекающими последствиями... Авторы пишут, что кислород ингибирует главным образом реакции под номерами Р4 и Р7.
Мне кстати интересно про нитрат в щелочной/нейтральной области. Ссылочкой поделишься?
Мне кстати интересно про нитрат в щелочной/нейтральной области. Ссылочкой поделишься?
Бог даёт лучшее тому, кто оставляет выбор за Ним
- Droog_Andrey
- Сообщения: 2695
- Зарегистрирован: Сб сен 29, 2007 8:29 pm
- Контактная информация:
Re: уравнение реакции сульфата железа с азотной кислотой
Гм. Я в основном из практических наблюдений исхожу. Интересная статья.
В щелочной области теоретически можно было бы восстановить нитрат вообще до аммиака. Но практически с этим как-то туго.
В щелочной области теоретически можно было бы восстановить нитрат вообще до аммиака. Но практически с этим как-то туго.
2^74207281-1 is prime!
- Avak_Avakyan
- Сообщения: 95
- Зарегистрирован: Пн июн 15, 2015 10:08 pm
 Смотрите на ВИДЕО, как это происходит!!
Смотрите на ВИДЕО, как это происходит!!
Так’с, господà теоретики.  Обратился я к самому надёжному и достоверному источнику — к собственной практике.
Обратился я к самому надёжному и достоверному источнику — к собственной практике.  И заснял на ВИДЕО (нажмите, чтобы СКАЧАТЬ; 7028 Кб, формат wmv), как это происходит. Скажу сразу: финал Вам покажется абсолютно неожиданным и необъяснимым…
И заснял на ВИДЕО (нажмите, чтобы СКАЧАТЬ; 7028 Кб, формат wmv), как это происходит. Скажу сразу: финал Вам покажется абсолютно неожиданным и необъяснимым…  Однако сперва отвечу на то, что тут обсуждалось, пока я возился с химикатами.
Однако сперва отвечу на то, что тут обсуждалось, пока я возился с химикатами.
 реакции нитрования органики. Туалетную бумагу HNO3 средней концентрации интенсивно окисляет, разлагая, желтея и пуская клубы NO2. А вот 100% HNO3, да ещё и в присутствие водоотнимающих средств, ВООБЩЕ её НЕ окисляет (назло Вам, Droog_Andrey!), а «нитрует» (делая милую пиробумагу), что по сути — тот же мирный ионный обмен, что и в реакции:
реакции нитрования органики. Туалетную бумагу HNO3 средней концентрации интенсивно окисляет, разлагая, желтея и пуская клубы NO2. А вот 100% HNO3, да ещё и в присутствие водоотнимающих средств, ВООБЩЕ её НЕ окисляет (назло Вам, Droog_Andrey!), а «нитрует» (делая милую пиробумагу), что по сути — тот же мирный ионный обмен, что и в реакции:
FeSO4 + 2HNO3 ↔ Fe(NO3)2 + H2SO4.
А если HNO3 совсем уж разбавить водой, то она — опять же перестаёт окислять, и начинает нитровать даже алканы, устраивая с ними опять же по сути ионный обмен, выступая по отношению к ним в роли щёлочи (реакция Коновалова). Это, подчёркиваю, НЕ линейное соотношение скорости и концентрации, а это РАЗНЫЕ «качества» (даже разные реакции). Так что идея о том, что разбавленная HNO3 всё равно «угробит» FeSO4, но сделает это медленно, а он всё равно в воде медленно «суициднётся», — это НЕ так.
Про то, что это НЕ так, вот нажмите практику; а ещё ВОТ ФОТОГРАФИЯ выращенных кристаллов FeII+(NO3)2×6H2O.
Итак, вывод первый: разбавленная HNO3 не разрушает FeSO4×7H2O, а лишь вступает с ним в обратимый ионный обмен, смещённый в сторону исходных веществ:
FeSO4 + 2HNO3 ↔ Fe(NO3)2 + H2SO4.
Ну и теперь о моей практике. Вначале об исходных веществах. Я хотел взять железный купорос, НЕ содержащий FeIII+. Так как магазинный продукт (особенно тот, что долго хранился) всегда содержит примесь FeIII+ (и от этого его водный раствор имеет желтовато−коричневатый оттенок), я растворил его в аккумуляторном электролите (H2SO4 средней концентрации) и всыпал железные опилки; час бурно перемешивал (выделялась смесь H2 и SO2); затем отфильтровал. Раствор получился полностью БЕЗ желтовато−коричневатого оттенка. Затем я решил получить HNO3 средней концентрации, но полностью БЕЗ примеси нитрозных газов. Получил из того же электролита по реакции:
H2SO4 + Ca(NO3)2 = CaSO4↓ + 2HNO3. Чтобы отделить гипс, промокашки не годятся, так как эти кислоты в этой концентрации разлагают бумагу, выделяя NO2 и окрашиваясь в жёлтый цвет; поэтому я отфильтровал HNO3 от гипса через многослойную стекловату. Она всё же очень проницаема, поэтому требуется «хитрость»: сперва идёт грязный фильтрат; но затем волокна забиваются гипсом, и фильтрат становится чистым; то есть через некоторое время нужно сменить приёмную ёмкость на новую и заново отфильтровать (когда фильтр становится «достаточно забившимся»).
Это про исходные вещества. А теперь про то, что я всех прошу скачать на моём видеоролике. В нём Вы увидите два стакана: один — с раствором железного купороса в аккумуляторном электролите, предварительно очищенном от FeIII+ железными опилками. Обратите внимание на ЦВЕТ этого раствора (серо−зелёный БЕЗ примеси желтовато−коричневатого оттенка). Во втором стакане примерно вдвое меньшее количество смеси аккумуляторного электролита с азотной кислотой. Далее я перед оком видеокамеры наливаю HNO3 в раствор FeSO4 и бурно перемешиваю. Визуально реакция первые пару минут не идёт. А затем смесь медленно темнеет. Реакция идёт примерно сутки, и чтобы видеофильм не длился столько же, я просто делал стоп−кадры спустя указанное в фильме время. Для экономии байтов, фильм БЕЗ звука (всё понятно из надписей на экране). Через несколько минут раствор (БЕЗ перемешивания) уже сильно потемнел, а через час стал очень тёмного красно−коричневого цвета. При этом в нём абсолютно НЕ появился ни один пузырёк газа, но над ним отчётливо ощущался запах NO2. Я оставил раствор на ночь. Через 12 часов (уже днём) оказалось, что раствор ОПЯТЬ посветлел и позеленел!! Он приобрёл облик раствора неочищенного от FeIII+ изначального «магазинного» железного купороса (серо−зелёный с желтовато−коричневатым оттенком).
я просто делал стоп−кадры спустя указанное в фильме время. Для экономии байтов, фильм БЕЗ звука (всё понятно из надписей на экране). Через несколько минут раствор (БЕЗ перемешивания) уже сильно потемнел, а через час стал очень тёмного красно−коричневого цвета. При этом в нём абсолютно НЕ появился ни один пузырёк газа, но над ним отчётливо ощущался запах NO2. Я оставил раствор на ночь. Через 12 часов (уже днём) оказалось, что раствор ОПЯТЬ посветлел и позеленел!! Он приобрёл облик раствора неочищенного от FeIII+ изначального «магазинного» железного купороса (серо−зелёный с желтовато−коричневатым оттенком).
Таким образом, я вынужден признать, что будучи прав касательно разбавленной HNO3, я был НЕправ касательно HNO3 средней концентрации. Она действительно окисляет железный купорос. Однако, показанные в моём фильме процессы куда экзотичнее, чем все Вы здесь предполагали. Ведь если принять красно−коричневый продукт за FeIII+2(SO4)3, то как же объяснить финальное посветление и позеленение?!! Да, кстати: наутро (через 12 часов после начала взаимодействия) я обнаружил на поверхности результирующего раствора крупные стойкие пузыри бесцветного газа ( явно NO ). Их Вы тоже увидите в моём видеоролике. Подождав до вечера (так что с начала взаимодействия прошли сутки), я заснял этот результат.
Ведь если принять красно−коричневый продукт за FeIII+2(SO4)3, то как же объяснить финальное посветление и позеленение?!! Да, кстати: наутро (через 12 часов после начала взаимодействия) я обнаружил на поверхности результирующего раствора крупные стойкие пузыри бесцветного газа ( явно NO ). Их Вы тоже увидите в моём видеоролике. Подождав до вечера (так что с начала взаимодействия прошли сутки), я заснял этот результат.
В реальности происходит вот что:
1). Идёт реакция окисления:
6FeSO4 + 2HNO3 + 3H2SO4 = 3Fe2(SO4)3 + 4H2O + 2NO.
2). Выделяющийся в ней NO не выделяется в виде газа, а сразу поглощается оставшимся в растворе FeSO4 с образованием нитрозосульфата желèза FeNOSO4. Именно ЭТО координационное соединение имеет тёмный красно−коричневый цвет. И самое дивное, что этот комплекс устойчив к HNO3. Таким образом, HNO3 окисляет лишь часть FeSO4, а выделяющийся при этом NO связывается оставшимся FeSO4 в FeNOSO4, защищая его от окисления HNO3. Нитрозосульфат желèза малоустойчив и за несколько часов разлагается на исходные компоненты, то есть выделяет NO и высвобождает FeSO4. И мы видим конечный результат: пузыри NO на поверхности и раствор, имеющий серо−зелёный цвет железного купороса, подкрашенный желтовато−коричневым оттенком Fe2(SO4)3, который сотворила азотная кислота в «первом акте» нашей химдрамы.
Видеоролик получился хороший; думаю, он будет прекрасным пособием и экономией времени для преподавателей, быстро и эффектно показывая долгую реакцию. Так что ПРЕДЛОЖЕНИЕ К МОДЕРАТОРАМ — поместить этот видеофайл в библиотечную коллекцию chemport.ru для свободного скачивания, чтобы он у всех на виду был.
Этот мой эксперимент, однако, НЕ на все вопросы ответил. Как я сказал выше, чистая HNO3 органику нитрует, но не окисляет (по крайней мере, нитрование можно проводить так, чтобы окисление не происходило). ОЧЕНЬ интересно: будет ли 100% HNO3, очищенная от нитрозных газов (добавить мочевину) и в присутствие водоотнимающих веществ (P4O10), окислять БЕЗводный негидратированный (прокаленный) FeSO4 при комнатной t°? У меня пыл закончился. Кто продолжит эстафету (сделает этот эксперимент)?!
Я не только об образовании. Я о выборе между приспособленчеством и правдоискательством (между путём «титушек» и путём «юродивых»). Этот выбор имеется везде от детских садов до правительственных хоромов. Я подчеркнул, что в этом выборе я ВСЕГДА на стороне Джордано Бруно, который готов подставить хоть жизнь на Земле ради того, чтобы порассуждать на отвлечённые темы и высказать о них своё мнение.C10H16 писал(а):Коллега, давайте в этой теме обойдемся без обсуждения нюансов системы образования
Вы рассуждаете так, будто бы речь о линейной «зависимости злости» от концентрации: якобы, чем крепче — тем «злее»; и вывод: якобы, при низких концентрациях всё то же самое, но просто медленнее. Но в действительности у нас НЕ линейная зависимость «злости» и скорости от концентрации, а разные «Гегелевские КАЧЕСТВА», которые возникают от разного «количества». Вспомним всеми нами нежно обожаемыеDroog_Andrey писал(а):делая из спокойного нитрата злую молекулу азотки
FeSO4 + 2HNO3 ↔ Fe(NO3)2 + H2SO4.
А если HNO3 совсем уж разбавить водой, то она — опять же перестаёт окислять, и начинает нитровать даже алканы, устраивая с ними опять же по сути ионный обмен, выступая по отношению к ним в роли щёлочи (реакция Коновалова). Это, подчёркиваю, НЕ линейное соотношение скорости и концентрации, а это РАЗНЫЕ «качества» (даже разные реакции). Так что идея о том, что разбавленная HNO3 всё равно «угробит» FeSO4, но сделает это медленно, а он всё равно в воде медленно «суициднётся», — это НЕ так.
Про то, что это НЕ так, вот нажмите практику; а ещё ВОТ ФОТОГРАФИЯ выращенных кристаллов FeII+(NO3)2×6H2O.
Итак, вывод первый: разбавленная HNO3 не разрушает FeSO4×7H2O, а лишь вступает с ним в обратимый ионный обмен, смещённый в сторону исходных веществ:
FeSO4 + 2HNO3 ↔ Fe(NO3)2 + H2SO4.
Ну и теперь о моей практике. Вначале об исходных веществах. Я хотел взять железный купорос, НЕ содержащий FeIII+. Так как магазинный продукт (особенно тот, что долго хранился) всегда содержит примесь FeIII+ (и от этого его водный раствор имеет желтовато−коричневатый оттенок), я растворил его в аккумуляторном электролите (H2SO4 средней концентрации) и всыпал железные опилки; час бурно перемешивал (выделялась смесь H2 и SO2); затем отфильтровал. Раствор получился полностью БЕЗ желтовато−коричневатого оттенка. Затем я решил получить HNO3 средней концентрации, но полностью БЕЗ примеси нитрозных газов. Получил из того же электролита по реакции:
H2SO4 + Ca(NO3)2 = CaSO4↓ + 2HNO3. Чтобы отделить гипс, промокашки не годятся, так как эти кислоты в этой концентрации разлагают бумагу, выделяя NO2 и окрашиваясь в жёлтый цвет; поэтому я отфильтровал HNO3 от гипса через многослойную стекловату. Она всё же очень проницаема, поэтому требуется «хитрость»: сперва идёт грязный фильтрат; но затем волокна забиваются гипсом, и фильтрат становится чистым; то есть через некоторое время нужно сменить приёмную ёмкость на новую и заново отфильтровать (когда фильтр становится «достаточно забившимся»).
Это про исходные вещества. А теперь про то, что я всех прошу скачать на моём видеоролике. В нём Вы увидите два стакана: один — с раствором железного купороса в аккумуляторном электролите, предварительно очищенном от FeIII+ железными опилками. Обратите внимание на ЦВЕТ этого раствора (серо−зелёный БЕЗ примеси желтовато−коричневатого оттенка). Во втором стакане примерно вдвое меньшее количество смеси аккумуляторного электролита с азотной кислотой. Далее я перед оком видеокамеры наливаю HNO3 в раствор FeSO4 и бурно перемешиваю. Визуально реакция первые пару минут не идёт. А затем смесь медленно темнеет. Реакция идёт примерно сутки, и чтобы видеофильм не длился столько же,
Таким образом, я вынужден признать, что будучи прав касательно разбавленной HNO3, я был НЕправ касательно HNO3 средней концентрации. Она действительно окисляет железный купорос. Однако, показанные в моём фильме процессы куда экзотичнее, чем все Вы здесь предполагали.
В реальности происходит вот что:
1). Идёт реакция окисления:
6FeSO4 + 2HNO3 + 3H2SO4 = 3Fe2(SO4)3 + 4H2O + 2NO.
2). Выделяющийся в ней NO не выделяется в виде газа, а сразу поглощается оставшимся в растворе FeSO4 с образованием нитрозосульфата желèза FeNOSO4. Именно ЭТО координационное соединение имеет тёмный красно−коричневый цвет. И самое дивное, что этот комплекс устойчив к HNO3. Таким образом, HNO3 окисляет лишь часть FeSO4, а выделяющийся при этом NO связывается оставшимся FeSO4 в FeNOSO4, защищая его от окисления HNO3. Нитрозосульфат желèза малоустойчив и за несколько часов разлагается на исходные компоненты, то есть выделяет NO и высвобождает FeSO4. И мы видим конечный результат: пузыри NO на поверхности и раствор, имеющий серо−зелёный цвет железного купороса, подкрашенный желтовато−коричневым оттенком Fe2(SO4)3, который сотворила азотная кислота в «первом акте» нашей химдрамы.
Видеоролик получился хороший; думаю, он будет прекрасным пособием и экономией времени для преподавателей, быстро и эффектно показывая долгую реакцию. Так что ПРЕДЛОЖЕНИЕ К МОДЕРАТОРАМ — поместить этот видеофайл в библиотечную коллекцию chemport.ru для свободного скачивания, чтобы он у всех на виду был.
Этот мой эксперимент, однако, НЕ на все вопросы ответил. Как я сказал выше, чистая HNO3 органику нитрует, но не окисляет (по крайней мере, нитрование можно проводить так, чтобы окисление не происходило). ОЧЕНЬ интересно: будет ли 100% HNO3, очищенная от нитрозных газов (добавить мочевину) и в присутствие водоотнимающих веществ (P4O10), окислять БЕЗводный негидратированный (прокаленный) FeSO4 при комнатной t°? У меня пыл закончился. Кто продолжит эстафету (сделает этот эксперимент)?!
У вас нет необходимых прав для просмотра вложений в этом сообщении.
Ивана Царевича от ВЗРОСЛЫХ братьев отличает НЕ гениальность, а девственность. Подоночность, серость, тупость и пассивность — это НЕ врождённая бездарность, а НЕРЕСТОВЫЕ изменения, именуемые в мире рыб ЛОШАНИЕМ, а в мире людей СТЕПЕННОСТЬЮ и ВЗРОСЛОСТЬЮ. ©
Re: уравнение реакции сульфата железа с азотной кислотой
Да, интересный результат!
Про что, а вот про π-связывание NO с Fe я вообще упустил из виду.
Про что, а вот про π-связывание NO с Fe я вообще упустил из виду.
When you open your heart to patriotism, there is no room for prejudice.
Re: уравнение реакции сульфата железа с азотной кислотой
FeNOSO4 - это предположение, а не факт. Образование такого соединения в похожих условиях известно https://books.google.de/books?id=XBjWCQ ... &q&f=false (на украинском, но кому не понятно - переведу), но "нету спектра" - "нету вещества". Хотя обосновано хорошо.
Концентрации реагентов неясны поэтому сложно судить на что там хватило азотки.
чистая HNO3 органику нитрует, но не окисляет - это зависит от органики. Из моей практики - ипсозамешение галогена в галофенолах заканчивается окислением в хиноны.
Библиотеки тут нет.
Концентрации реагентов неясны поэтому сложно судить на что там хватило азотки.
чистая HNO3 органику нитрует, но не окисляет - это зависит от органики. Из моей практики - ипсозамешение галогена в галофенолах заканчивается окислением в хиноны.
Библиотеки тут нет.
Re: уравнение реакции сульфата железа с азотной кислотой
Результат интересный.
Чтобы получить азотку без нитрозных газов, достаточно в темноте пробулькивать через неё воздух несколько часов.
Чтобы получить азотку без нитрозных газов, достаточно в темноте пробулькивать через неё воздух несколько часов.
"Я не видел людей страшней, чем толпа цвета хаки"
Re: Смотрите на ВИДЕО, как это происходит!!
Не очень убедительно.Avak_Avakyan писал(а): 1). Идёт реакция окисления:
6FeSO4 + 2HNO3 + 3H2SO4 = 3Fe2(SO4)3 + 4H2O + 2NO.
2). Выделяющийся в ней NO не выделяется в виде газа, а сразу поглощается оставшимся в растворе FeSO4 с образованием нитрозосульфата желèза FeNOSO4.
Нитрозосульфат желèза малоустойчив и за несколько часов разлагается на исходные компоненты, то есть выделяет NO и высвобождает FeSO4. И мы видим конечный результат: пузыри NO на поверхности
Если нитрозосульфат желèза малоустойчив и легко разлагается, то зачем ему образовываться?
NO может и просто растворяться, димеризоваться, окисляться кислородом воздуха до NO2, "забуривая" раствор, с последующим образованием из него азотной и азотистой кислот, с осветлением раствора и выделением того же NO в газовую фазу при распаде азотистой кислоты.
2NO → N2O2
N2O2 + O2 → 2NO2
2NO2 + H2O → HNO3 + HNO2
3HNO2 → HNO3 + 2NO↑ + H2O
Находит тот, кто ищет не там.
Re: уравнение реакции сульфата железа с азотной кислотой
Если правильно понял условие, то задача окислить, а не растворить.Анна89 писал(а):В задаче просто написано, что нужно окислить железо с помощью азотной кислоты. Про серную ничего.
Образование окисной пленки на железе путем пассивирования его в азотной кислоте. Тщательно очищают и обезжиривают железный гвоздь и помещают его на 1—2 минуты в пробирку с концентрированной азотной кислотой. За это время железо пассивируется— покрывается прочным слоем из окислов железа. Гвоздь промывают в воде и опускают в раствор серной кислоты (1 5). Выделение водорода не происходит. Для контроля в серную кислоту опускают гвоздь, не обработанный азотной кислотой. Водород выделяется.
http://chem21.info/info/132775/
Сократ мне друг, но истина дороже.
- Avak_Avakyan
- Сообщения: 95
- Зарегистрирован: Пн июн 15, 2015 10:08 pm
 ВИДЕО — восстановление Fe3+ до Fe2+ железом в H2SO4
ВИДЕО — восстановление Fe3+ до Fe2+ железом в H2SO4
Сперва даю ещё один свой ВИДЕОоролик — последний про этот эксперимент — про восстановление солей FeIII+ до солей FeII+ посредством растворяющегося в кислоте металла. Ранее я указывал, что растворяющиеся в кислоте металлы — сильные восстановители, и что, следовательно, в разбавленной HNO3 железо растворится с образованием именно FeII+(NO3)2, потому что растворяющийся в кислоте металл и появляющийся при этом водород будут восстанавливать в этом растворе FeIII+ в случае его появления. «Магазинный» железный купорос (в особенности, долго хранившийся) всегда содержит примесь FeIII+, придающий его раствору жёлто−коричневый оттенок. Чтобы получить раствор железного купороса, не содержащий FeIII+, я растворил «магазинный» железный купорос в аккумуляторном электролите (H2SO4 средней концентрации) и бросил в него железные опилки (напильником поточил гвоздь, чтобы их получить).
Вот этот мой ВИДЕОРОЛИК (нажмите, чтобы СКАЧАТЬ; 7179 Кб, формат wmv). «За кадром» осталось то, что это растворение железных опилок длилось час, и весь этот час я максимально интенсивно непрерывно перемешивал этот раствор, чтобы восстановление шло на всех его участках; а затем профильтровал результат. Видно, что жёлто−коричневый оттенок исчез; раствор остался слабо окрашенный в серо−зелёный цвет FeII+. Именно с этим раствором я делал эксперимент, заснятый в предыдущем фильме. Опять же — рекомендую это видео для демонстрации учащимся. Это — наглядный пример, как растворяющийся в кислоте металл переводит находящуюся в этом растворе соль FeIII+ в соль FeII+. Выделяющийся газ был смесью H2 с SO2 (последний отчётливо констатировался по запаху).
Теперь про образование FeNOSO4.
2NaNO3 + 6FeSO4 + 4H2SO4 [/color] → 3Fe2(SO4)3 + 2NO + Na2SO4 + 4H2O.
NO + FeSO4 → FeNOSO4.
Из более солидных очерков — см. венгерский опус (СКАЧАТЬ ЗДЕСЬ). У кого проблемы с венгерским, — есть ГуглТранслэйт. На второй странице подробно расписана судьба FeNOSO4 и эта реакция. Эта работа выглядит убедительно.
Я скажу, что без FeNOSO4 увиденные Вами на видео процессы вообще не объясняются. NO плохо растворим в воде. Если он возникает на первой стадии реакции, то почему же НЕ появляется ни одного пузырька? Однако именно в это время по ВСЕЙ толще раствора раствор равномерно темнеет. Логично предположить, что появляющийся по всей толще раствора NO сразу же связывается в FeNOSO4. Разрушение FeNOSO4 через несколько часов с высвобождением FeSO4 прекрасно объясняет, откуда возникает FeII+ в конце этого процесса (позеленение и посветление раствора). Ведь в этом растворе НЕТ восстановителей, могущих на заключительной стадии превратить FeIII+ в FeII+, после того, как HNO3 осуществила обратный процесс. Почему FeNOSO4 сперва возникает, а затем разрушается, — это объясняется количеством NO: когда концентрация NO велика, — растёт концентрация FeNOSO4; последний, будучи малоустойчив, со временем «выдыхается»: разлагается на поверхности раствора, а NO улетает в атмосферу комнаты, превращаясь в NO2. Концентрация улетающего с поверхности раствора NO падает в растворе; то бишь улетучивание NO с поверхности раствора делает разрушение FeNOSO4 необратимым (продукт реакции уходит из сферы реакции).
Эти разъяснения про FeNOSO4 мне кажутся убедительными. Неясным остаётся вопрос: как поступит чистая 100% HNO3 с безводным НЕгидратированным FeSO4? Без эксперимента этот вопрос решён не будет. Кто решится попробовать?
P.S. Скачайте мой второй ВИДЕОролик по этой ссылке.
Вот этот мой ВИДЕОРОЛИК (нажмите, чтобы СКАЧАТЬ; 7179 Кб, формат wmv). «За кадром» осталось то, что это растворение железных опилок длилось час, и весь этот час я максимально интенсивно непрерывно перемешивал этот раствор, чтобы восстановление шло на всех его участках; а затем профильтровал результат. Видно, что жёлто−коричневый оттенок исчез; раствор остался слабо окрашенный в серо−зелёный цвет FeII+. Именно с этим раствором я делал эксперимент, заснятый в предыдущем фильме. Опять же — рекомендую это видео для демонстрации учащимся. Это — наглядный пример, как растворяющийся в кислоте металл переводит находящуюся в этом растворе соль FeIII+ в соль FeII+. Выделяющийся газ был смесью H2 с SO2 (последний отчётливо констатировался по запаху).
В концентрированной азотной кислоте железо пассивируется; а в разбавленной растворяется.stallker писал(а):Гвоздь… пассивирования его в азотной кислоте
Если в ту же смесь H2SO4 и HNO3 средней концентрации положить туалетную бумагу, она быстро потемнеет, будет выделяться много NO2, и этот NO2 окрасит кислотную смесь в золотисто−жёлтый, но НЕ более тёмный цвет.Sovetnik писал(а):NO может и просто растворяться, димеризоваться, окисляться кислородом воздуха до NO2, "забуривая" раствор, с последующим образованием из него азотной и азотистой кислот, с осветлением раствора и выделением того же NO в газовую фазу при распаде азотистой кислоты.
А из моей практики — смесь NH4NO3 с H2SO4 (93% «аккумуляторная») при всыпании в неё мелко растёртого аспирина и перемешивании за пару мгновений сама ЗАКИПАЕТ, долго булькает NO2, а после окончания реакции если нейтрализовать её содой, — количественно выпадает пикрат аммония. То есть ацетильный «хвост» нитрующая смесь именно ОКИСЛЯЕТ, а остальное НИТРУЕТ (ещё и декарбоксилируя). Эта реакция активно обсуждается на форумах, но самопальщики, как правило, не знают, что «ноу хау» заключается в необходимости большого избытка H2SO4, то есть смесь должна быть очень жидкой, а НЕ мёдообразной. При недостатке H2SO4 вышеописанного бурного «старта» (с закипанием) НЕ происходит; химики сами пытаются греть эту смесь, и результатом оказывается смесь недонитрованных продуктов. Кстати, 100% HNO3 способна поджигать скипидар (см. ЗДЕСЬ). Но всё это НЕ опровергает того, что HNO3 средней концентрации, как правило, окисляет органику; а вот 100% HNO3 может и вовсе НЕ окислять, а нитровать, то есть ограничиваться по сути ионным обменом. Исходя из этого, вполне может оказаться, что 100% HNO3 не станет окислять безводный негидратированный FeSO4; чтобы знать, как пойдёт (или не пойдёт) эта реакция, нужен только эксперимент.Гесс писал(а):Из моей практики - ипсозамешение галогена в галофенолах заканчивается окислением в хиноны.
Теперь про образование FeNOSO4.
Большего любителя ниспровергать скрепы и догмы чем я не бывает; но здесь мне видится, что перед нами Истина. Возникновение тёмноокрашенного FeNOSO4 при проведённой мною реакции HNO3 с FeSO4 нынче вообще используется как тест на HNO3 (я сам об этом только сейчас узнал). Вот ЗДЕСЬ Вы можете скачать реферат, где сказано: «Колометрический метод с применением сернокислого желèза. Метод базируется на реакции сернокислого желèза с нитратами в кислой среде с образованием соединения FeNOSO4… устойчивого в течение нескольких часов. В качестве реагента используют раствор сернокислого желèза в H2SO4. На точность определения влияет содержание в растворе нитритов и тиосульфатов.». Вот методическое пособие (СКАЧАТЬ ЗДЕСЬ), где на стр. 37 читаем тест на нитраты: «Реакция с сульфатом желèза (II) и концентрированной серной кислотой. … Окись азота с избытком реактива образует непрочные комплексные ионы (FеNO)2+ бурого цвета. Реакцию с образованием того же соединения даёт и нитрит−ион, поэтому нельзя открыть этой реакцией нитрат−ион в присутствии нитрит−иона. Выполнение реакции. а) К 5−6 каплям насыщенного раствора FеSО4 добавляют 2−3 капли нитрата натрия и перемешивают. Затем осторожно по стенке пробирки приливают 5−6 капель концентрированной серной кислоты так, чтобы жидкости не смешивались. В месте соприкосновения обеих жидкостей появляется тёмно−бурое окрашивание жидкости (кольцо). б) Реакцию можно выполнить таким способом. На поверхность стеклянной пластинки помещают 2−3 капли раствора NаNО3, к которому прибавляют маленький кристаллик FеSО4 и каплю концентрированной серной кислоты - Н2SО4. Вокруг кристаллика FеSО4 образуется комплексное соединение [FеNО]SО4 бурого цвета.». На стр. 39 сказано, что кроме нитратов эту же реакцию дают и нитриты. Вот ещё одно пособие (СКАЧАТЬ ЗДЕСЬ); в нём на стр. 43 читаем аналогичный текст и видим уравнения:Гесс писал(а):FeNOSO4 — это предположение, а не факт.
2NaNO3 + 6FeSO4 + 4H2SO4 [/color] → 3Fe2(SO4)3 + 2NO + Na2SO4 + 4H2O.
NO + FeSO4 → FeNOSO4.
Из более солидных очерков — см. венгерский опус (СКАЧАТЬ ЗДЕСЬ). У кого проблемы с венгерским, — есть ГуглТранслэйт. На второй странице подробно расписана судьба FeNOSO4 и эта реакция. Эта работа выглядит убедительно.
Я скажу, что без FeNOSO4 увиденные Вами на видео процессы вообще не объясняются. NO плохо растворим в воде. Если он возникает на первой стадии реакции, то почему же НЕ появляется ни одного пузырька? Однако именно в это время по ВСЕЙ толще раствора раствор равномерно темнеет. Логично предположить, что появляющийся по всей толще раствора NO сразу же связывается в FeNOSO4. Разрушение FeNOSO4 через несколько часов с высвобождением FeSO4 прекрасно объясняет, откуда возникает FeII+ в конце этого процесса (позеленение и посветление раствора). Ведь в этом растворе НЕТ восстановителей, могущих на заключительной стадии превратить FeIII+ в FeII+, после того, как HNO3 осуществила обратный процесс. Почему FeNOSO4 сперва возникает, а затем разрушается, — это объясняется количеством NO: когда концентрация NO велика, — растёт концентрация FeNOSO4; последний, будучи малоустойчив, со временем «выдыхается»: разлагается на поверхности раствора, а NO улетает в атмосферу комнаты, превращаясь в NO2. Концентрация улетающего с поверхности раствора NO падает в растворе; то бишь улетучивание NO с поверхности раствора делает разрушение FeNOSO4 необратимым (продукт реакции уходит из сферы реакции).
Эти разъяснения про FeNOSO4 мне кажутся убедительными. Неясным остаётся вопрос: как поступит чистая 100% HNO3 с безводным НЕгидратированным FeSO4? Без эксперимента этот вопрос решён не будет. Кто решится попробовать?
P.S. Скачайте мой второй ВИДЕОролик по этой ссылке.
У вас нет необходимых прав для просмотра вложений в этом сообщении.
Последний раз редактировалось Avak_Avakyan Чт июн 25, 2015 1:53 pm, всего редактировалось 1 раз.
Ивана Царевича от ВЗРОСЛЫХ братьев отличает НЕ гениальность, а девственность. Подоночность, серость, тупость и пассивность — это НЕ врождённая бездарность, а НЕРЕСТОВЫЕ изменения, именуемые в мире рыб ЛОШАНИЕМ, а в мире людей СТЕПЕННОСТЬЮ и ВЗРОСЛОСТЬЮ. ©
Re: уравнение реакции сульфата железа с азотной кислотой
В том и дело, начинать надо с поставленной задачи окислить.Avak_Avakyan писал(а):В концентрированной азотной кислоте железо пассивируется; а в разбавленной растворяется.
Далее уточнения по условиям реакции и соответственно продукты реакции от условий,
в часности температуры и концентрации.
Сократ мне друг, но истина дороже.
- Avak_Avakyan
- Сообщения: 95
- Зарегистрирован: Пн июн 15, 2015 10:08 pm
 Re: уравнение реакции сульфата железа с азотной кислотой
Re: уравнение реакции сульфата железа с азотной кислотой
В понятие «ОКИСЛИТЬ» входит и понятие «РАСТВОРИТЬ» (не обязательно же «окалину получить»). Кстати, о понятиях «окислить» и «восстановить», следует отметить, что появились эти понятия: первое — применительно к вводу элемента в соединения, второе — к извлечению из соединений. Позднее эти понятия стали увязывать со степенями окисления и даже со знаком заряда элемента в соединениях; и стали возникать МАРАЗМЫ: например, я говорю — „Водород ВОССТАНАВЛИВАЕТ азотную кислоту, РАЗЛАГАЯ её до нитрозного газа.“; а меня переспрашивают: — „ЧТО ты сказал?! ВОССТАНАВЛИВАЕТ, РАЗЛАГАЯ?!!“.  А реакция Fe + 5CO = Fe(CO)5 — это «окисление», или «восстановление», если степень «окисления» Fe в этом соединении считается равной нулю?!!
А реакция Fe + 5CO = Fe(CO)5 — это «окисление», или «восстановление», если степень «окисления» Fe в этом соединении считается равной нулю?!! 
Ивана Царевича от ВЗРОСЛЫХ братьев отличает НЕ гениальность, а девственность. Подоночность, серость, тупость и пассивность — это НЕ врождённая бездарность, а НЕРЕСТОВЫЕ изменения, именуемые в мире рыб ЛОШАНИЕМ, а в мире людей СТЕПЕННОСТЬЮ и ВЗРОСЛОСТЬЮ. ©
Re: уравнение реакции сульфата железа с азотной кислотой
Не согласен. Существует процесс химического оксидирования металлов и сплавов.Avak_Avakyan писал(а): В понятие «ОКИСЛИТЬ» входит и понятие «РАСТВОРИТЬ» (не обязательно же «окалину получить»).
http://galvanikspb.ru/articles/himiches ... vanie.html
Из практики. Для стравливания гальванического никелеврго покрытия с чугунной гильзы
подбираю опимальную концентрацию и температуру азотной кислоты, в результате
никель растворяется, а чугун окисляется и от этого становится пассивным, то есть
пассивируется.
Сократ мне друг, но истина дороже.
Re: уравнение реакции сульфата железа с азотной кислотой
Продукт может быть разным, если водород атомарный, может получится гидроксиламин.Avak_Avakyan писал(а): „Водород ВОССТАНАВЛИВАЕТ азотную кислоту, РАЗЛАГАЯ её до нитрозного газа.
Сократ мне друг, но истина дороже.
Re: уравнение реакции сульфата железа с азотной кислотой
Я не могу читать столь длинный текст в таком вырвиглазном формате. Вечером переброшу в ворд - прочту.
- Avak_Avakyan
- Сообщения: 95
- Зарегистрирован: Пн июн 15, 2015 10:08 pm
 Re: уравнение реакции сульфата железа с азотной кислотой
Re: уравнение реакции сульфата железа с азотной кислотой
Согласен.stallker писал(а):Продукт может быть разным
В понятие «ОКИСЛИТЬ» бесспорно входит и понятие «РАСТВОРИТЬ», особенно, в нашем случае. Железо 1) вводится в соединение, 2) приобретает положительный заряд в нём, то есть по любой классификации растворение Fe в кислоте — это окисление. Если в школьной задаче требуют «окислить железо с помощью азотной кислоты», то бесспорно имеется ввиду именно перевод желèза в соединение, а не нечто вроде анодирования с целью пассивировать. Хотя — Ваш пример — ещё один образчик наличия разных смыслов у понятия «окислить».
Ивана Царевича от ВЗРОСЛЫХ братьев отличает НЕ гениальность, а девственность. Подоночность, серость, тупость и пассивность — это НЕ врождённая бездарность, а НЕРЕСТОВЫЕ изменения, именуемые в мире рыб ЛОШАНИЕМ, а в мире людей СТЕПЕННОСТЬЮ и ВЗРОСЛОСТЬЮ. ©
Re: уравнение реакции сульфата железа с азотной кислотой
пример из реальной многотоннажной технологии: соль слабой кислоты растворяется в азотной кислоте с вытеснением слабой кислоты и образованием нитрата. главный действующий катион заряд не меняет, и пока сыръе чистое, никаких проблем с выделением оксидов азота в технологии нет. при снижении качества сыръя начались проблемы с выбросами NOx. виновник найден в загрязнении сыръя катионами Fe2+ которые, предположительно окисляясь азоткой до 3+ вызывают появление NOx. прямая зависимость выбросов NOx от содержания железа в сыръе подтверждена однозначно.
- Avak_Avakyan
- Сообщения: 95
- Зарегистрирован: Пн июн 15, 2015 10:08 pm
 • Про волшебные пузырьки!! •
• Про волшебные пузырьки!! •
Интересный пример. А я тут в поисках информации о похожих нитрозилах нашёл вообще «убойные» вещи. Вот, например, «А. Уэллс. Структурная неорганическая химия. Том 2». См. стр. 572 (в файле стр. 286). Кроме того, рекомендую ещё один очень солидный опус: «Н.А. Санина. С.М. Алдошин. Синтез, строение и свойства моделей нитрозильных» [2Fe−2S], [1Fe−2S] протеинов и перспективы применения их в биологии и медицине». В этих книгах и в ряде других источников описывается, что растворы солей FeII+ реагируют с NO и водорастворимыми сульфидами с образованием солей с однозарядным анионом [Fe4S3(NO)7]- («Чёрные соли Руссена»; «Roussin's black salt»); действие на них щёлочей даёт менее устойчивые соли с двухзарядным анионом [Fe2S2(NO)2]2- («Красные соли Руссена»; «Roussin's red salt»).
Например,
FeSO4 + NO + (NH4)2S → NH4[Fe4S3(NO)7] (Чёрная соль Руссена).
NH4[Fe4S3(NO)7] + NH4OH → (NH4)2[Fe2S2(NO)2] (Красная соль Руссена).
Причём, последняя реакция обратима и её направление меняется от pH среды (и ещё и N2O выделяется):
2H+ + 4[Fe2S2(NO)2]2- → 2[Fe4S3(NO)7]- + 2S2- + N2O↑ + H2O.
И вот ЭТО приводит нас к большому вопросу о пузырях в конце моего первого видеоролика: уж не N2O ли в них?!! Sovetnik, помнится, усомнился по их поводу. Если NO реагирует с FeSO4, то почему же он столь стабильно покоится в пузырях над раствором FeSO4?! Но если в этих пузырях N2O, — нужно определить подробности: КАК он возник. А. Уэллс в вышеуказанной книге на той же странице делает предположение о возможности изомеризации нитрозокомплексов в гипонитриты: ведь это по сути димеризация двух нитрозогрупп в общий кислотный остаток -O─N═N─O-. А ведь N2O — продукт распада H2N2O2 (азотноватистой кислоты). Предположительно, может быть так:
2SO4Fe─N═O → SO4Fe─O─N═N─O─FeSO4 → 2FeIII+OHSO4 + H2N2O2 → N2O + H2O.
Но если это так, то результатом будет FeIII+. Может, FeNOSO4 умеет разлагаться по двум путям: 1) диссоциация на FeSO4 и NO, 2) изомеризация в гипонитрит с последующим выделением из него H2N2O2 под действием серной и азотной кислот и последующим распадом H2N2O2 под влиянием некоего компонента этой среды?
Ещё. Вы только гляньте:
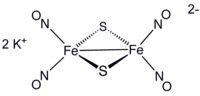
Строение Красной соли Руссена.

Строение Чёрной соли Руссена.
И гляньте на реакцию (Н.А. Санина. С.М. Алдошин.; см. выше):
2FeSO4 + 4M2S2O3 + 4NO → M2[Fe2(S2O3)2(NO)4] + M2S4O6 + 2M2SO4.
(M = K+, Na+).
Это СКОЛЬКО ЖЕ подобных реакций имеют место быть, когда железный купорос с серной кислотой используют как индикатор на нитраты, содержащиеся ЧЁРТИ В КАКОМ сырье?!!!
P.S. С учётом вышесказанного, какие мысли имеются про пузыри (N2O?) в конце моего первого видеоролика?
Например,
FeSO4 + NO + (NH4)2S → NH4[Fe4S3(NO)7] (Чёрная соль Руссена).
NH4[Fe4S3(NO)7] + NH4OH → (NH4)2[Fe2S2(NO)2] (Красная соль Руссена).
Причём, последняя реакция обратима и её направление меняется от pH среды (и ещё и N2O выделяется):
2H+ + 4[Fe2S2(NO)2]2- → 2[Fe4S3(NO)7]- + 2S2- + N2O↑ + H2O.
И вот ЭТО приводит нас к большому вопросу о пузырях в конце моего первого видеоролика: уж не N2O ли в них?!! Sovetnik, помнится, усомнился по их поводу. Если NO реагирует с FeSO4, то почему же он столь стабильно покоится в пузырях над раствором FeSO4?! Но если в этих пузырях N2O, — нужно определить подробности: КАК он возник. А. Уэллс в вышеуказанной книге на той же странице делает предположение о возможности изомеризации нитрозокомплексов в гипонитриты: ведь это по сути димеризация двух нитрозогрупп в общий кислотный остаток -O─N═N─O-. А ведь N2O — продукт распада H2N2O2 (азотноватистой кислоты). Предположительно, может быть так:
2SO4Fe─N═O → SO4Fe─O─N═N─O─FeSO4 → 2FeIII+OHSO4 + H2N2O2 → N2O + H2O.
Но если это так, то результатом будет FeIII+. Может, FeNOSO4 умеет разлагаться по двум путям: 1) диссоциация на FeSO4 и NO, 2) изомеризация в гипонитрит с последующим выделением из него H2N2O2 под действием серной и азотной кислот и последующим распадом H2N2O2 под влиянием некоего компонента этой среды?
Ещё. Вы только гляньте:

Строение Красной соли Руссена.

Строение Чёрной соли Руссена.
И гляньте на реакцию (Н.А. Санина. С.М. Алдошин.; см. выше):
2FeSO4 + 4M2S2O3 + 4NO → M2[Fe2(S2O3)2(NO)4] + M2S4O6 + 2M2SO4.
(M = K+, Na+).
Это СКОЛЬКО ЖЕ подобных реакций имеют место быть, когда железный купорос с серной кислотой используют как индикатор на нитраты, содержащиеся ЧЁРТИ В КАКОМ сырье?!!!
P.S. С учётом вышесказанного, какие мысли имеются про пузыри (N2O?) в конце моего первого видеоролика?
Ивана Царевича от ВЗРОСЛЫХ братьев отличает НЕ гениальность, а девственность. Подоночность, серость, тупость и пассивность — это НЕ врождённая бездарность, а НЕРЕСТОВЫЕ изменения, именуемые в мире рыб ЛОШАНИЕМ, а в мире людей СТЕПЕННОСТЬЮ и ВЗРОСЛОСТЬЮ. ©
Кто сейчас на конференции
Сейчас этот форум просматривают: нет зарегистрированных пользователей и 12 гостей