Спор о фазах, природе химической связи, валентности и степени окисления
- Droog_Andrey
- Сообщения: 2670
- Зарегистрирован: Сб сен 29, 2007 8:29 pm
- Контактная информация:
Re: Спор о фазах, природе химической связи, валентности и степени окисления
NF4+ будет съедать фторид-ион с относительно небольшим барьером, так что фигушки. А под давлением чего только не придумают...
2^74207281-1 is prime!
Re: Спор о фазах, природе химической связи, валентности и степени окисления
Придумать много чего можно. Но мы живём на поверхности матушки, а что делается в недрах в огромных масштабах не знаем.
"Я не видел людей страшней, чем толпа цвета хаки"
Re: Спор о фазах, природе химической связи, валентности и степени окисления
В аргоновой матрице, может быть, и можно наморозить. Но в NF4+ азот классический, четырёхвалентный. А вот получить под давлением октаэдр NF6- было бы реально интересно... Ведь наши "нормальные условия" нормальны лишь условно, это вопрос привычки. На самом деле, химия под давлением 40 ГПа ничуть не менее интересна и актуальна.Droog_Andrey писал(а): ↑Ср май 16, 2018 11:21 pmNF4+ будет съедать фторид-ион с относительно небольшим барьером, так что фигушки. А под давлением чего только не придумают...
When you open your heart to patriotism, there is no room for prejudice.
- Avak_Avakyan
- Сообщения: 95
- Зарегистрирован: Пн июн 15, 2015 10:08 pm
О НЕтождественности валентной и межмолекулярной связи
А Вы попробуйте гораздо менее одиозный PH4F получить.Droog_Andrey писал(а): ↑Ср май 16, 2018 11:21 pmNF4+ будет съедать фторид-ион с относительно небольшим барьером, так что фигушки.
Согласен.
А вот в NF6− я НЕ верю.
Пяти!! Кстати, в Википедии про «Стехиометрическую валентность» сказано, что она про «дальтониды без гомоцепей», но это тоже НЕправильно, потому что в этане углерод такой же четырёхвалентный, как и в метане, а в цепях полисульфидов сера двухвалентная. Даже про «одновалентную ртуть» всегда оговаривают, что она «формально одновалентная», а реально ДВУХвалентная, потому что связь металл−металл в катионе +Hg―Hg+ тоже учитывается как валентная.
Ещё и ещё раз: между комплексной межмолекулярной и валентной связями есть принципиальное РАЗЛИЧИЕ, заключающееся в том, что межмолекулярные связи НЕ изменяют зарядность!!! Про заряд — опять же есть двусмысленность со спором о разнице между ионами и (ФОРМАЛЬНО нейтральными) радикалами, но факт в том, что ионы и радикалы тождественны в том, что у обоих есть «неприкаянный» валентный электрон (либо его «недостача» в положительных ионах; а электрон ведь — ЗАРЯД!). Показываю эту РАЗНИЦУ: Вам «ковалентисты» глаголят, что связь C―C в этане и связь H2O→Cu в медном купоросе одинаковые («ковалентные»); замечательно; В СТУДИЮ соединение H2O―CH3!!! Поняли РАЗНИЦУ?!!! Ещё раз: она в том, что межмолекулярные связи НЕ изменяют зарядность. Порвав связь Na―Cl, Вы получаете «полсковороды» (ионы Na+ и Cl−); порвав любую связь в этане H―CH2―CH2―H, Вы так же получаете «полсковороды» (радикалы •H, •CH3 и •C2H5). И ионы, и радикалы стремятся немедленно образовать новую связь взамен разорванной, и это — реально валентная связь. А вот оторвав воду у медного купороса, Вы получаете самостоятельную молекулу, то есть НЕ радикал и НЕ ион. И вода не только способна к самостоятельному существованию, но она НЕспособна образовать стабильные соединения, добавив одну ЗАРЯДНУЮ связь (типа H2O―CH3, H2O―H, H2O―OH, H2O―Na, H2O―Cl). Про незадействованные валентные электроны кислорода воды — их−то ДВА, а не ОДИН! Поэтому когда они образуют РЕАЛЬНЫЕ ВАЛЕНТНЫЕ связи, — у нас получаются оксониевые структуры с четырёхвалентным кислородом. А когда вода образует координационную связь, — она образует ОДНУ такую связь, а НЕ ДВЕ; и эта связь НЕ имеет ЗАРЯДА, что не позволяет нам отождествить гидраты с оксониевыми структурами!!! Понятна РАЗНИЦА между валентными и межмолекулярными связями (она — в ЗАРЯДЕ)?!!!
А теперь об истории «ковалентистов». КАК классифицировать химсвязи? Изначально классифицировали именно по наличию ЗАРЯДА: ионные, ковалентные и металлические связи, появляясь, меняют ЗАРЯДНОСТЬ атома. Поэтому мы «рисуем чёрточки» и получаем строжайшее соответствие формул «стехиометрической валентности». Те же связи, появление которых НЕ меняет ЗАРЯДНОСТЬ атома, рассматривались как «налипания» за счёт «остаточных намагниченностей» (идея Ван−дер−ваальса).
Затем появилась теория Вернера, и появился ЧИСТО СОЦИАЛЬНЫЙ фактор: Вернеру для «вхождения в историю» захотелось «ОБСТОЛБИТЬ» некий класс соединений как «Новый ВЕРНЕРОВСКИЙ раздел, ОТКРЫТЫЙ ВЕРНЕРОМ» (чистейшая СОЦИОЛОГИЯ)!! Понятия «комплексы» и «межмолекулярные ассоциаты» ужè существовали ДО Вернера. Поэтому Вернер абсолютно НЕобоснованно выделил «СВОЙ КЛАСС» («Координационные соединения») по фактору «СТЕПЕНИ УСТОЙЧИВОСТИ» в растворах. КООРДИНАЦИЯ вокруг некоего атома оказалась «фактором отличия» «ВЕРНЕРОВСКОГО НОВОГО КОНТИНЕНТА химии» от «простых» ассоциатов типа дигидроля или гейлюссита с тихитом, хотя ТИП СВЯЗИ во ВСЕХ межмолекулярных соединениях ОДИНАКОВ в том, что эта связь — БЕЗЗАРЯДНАЯ (а так как ЗАРЯДНАЯ именовалась ВАЛЕНТНОЙ, межмолекулярная считалась НЕвалентной: нет связи посредством валентного электрона, НЕ изменяется зарядность атома).
А затем — поствернеровские исследователи «координационных соединений» решили пойти дальше, и БЛОК, стойкий в растворах, объявить единицей вещества. Мол, противоионы менять можно, они преходящи; а вот основа структуры — стойкий в растворах БЛОК. Далее — следующий СОЦИАЛЬНЫЙ ФАКТОР: Полингу и Лондону хотелось Нобелевскую премию за «ЕДИНУЮ ТЕОРИЮ химсвязи»!! Взяв за основу идею, что остов вещества — это стойкий в растворах БЛОК, они глянули: что ведёт себя аналогично в обычных валентных соединениях? И сразу узрели: — углеводородные остовы. В этом они увидели ОБЩЕЕ. А далее пошла СОФИСТИКА: когда узрев один атрибут ОБЩНОСТИ, делается огульный вывод о ТОЖДЕСТВЕ: раз связи в углеводородах ковалентные, — значит аналогично стойкие в растворах межмолекулярные блоки — тоже ковалентные. Координационные числа Вернера ОТОЖДЕСТВИЛИ с неионными связями в углеводородах, и получилось НОВОЕ абсолютно хаотическое понятие «валентности», когда химик видит НЕ целый продукт K4Fe(CN)6, а лишь ПОЛСКОВОРОДЫ [Fe(CN)6]4− или ПОЛТОРА ДРОВОСЕКА AlO45−. А дальше — хуже. Так как межмолекулярные связи в кристалле иные, чем в ассоциате из нескольких молекул, а ПРИРОДА межмолекулярных связей та же самая, — в понятие «валентность» попытались добавить «координационное число в кристалле», а в нём идея ПОЛУТОРА ДРОВОСЕКОВ вообще идёт без усматривания границ между тем, что пишется химформулой как химсостав СОЕДИНЕНИЯ.
Всё это даёт ПРОСТО ХАОС. Но дело НЕ только в классификациях: как бы ни былà похожа межмолекулярная связь на валентную на спектрометре, между ними есть РЕАЛЬНАЯ РАЗНИЦА!!! Эта разница в том, что при разрыве межмолекулярной связи мы НЕ получаем ион или радикал, и зарядность НЕ меняется!!!
Ивана Царевича от ВЗРОСЛЫХ братьев отличает НЕ гениальность, а девственность. Подоночность, серость, тупость и пассивность — это НЕ врождённая бездарность, а НЕРЕСТОВЫЕ изменения, именуемые в мире рыб ЛОШАНИЕМ, а в мире людей СТЕПЕННОСТЬЮ и ВЗРОСЛОСТЬЮ. ©
Re: О НЕтождественности валентной и межмолекулярной связи
Вот интересно, что изменяет заряд атома, а что не изменяет: связь С-С в этане изменяет ли заряд атома углерода? А связь Fe-C в [Fe(CO)5] изменяет ли заряд атома железа? Если да, то в каком случае насколько? Не надо филологии, дайте ссылку на конкретные результаты измерений.Avak_Avakyan писал(а): ↑Чт май 17, 2018 2:39 pmмежду комплексной межмолекулярной и валентной связями есть принципиальное РАЗЛИЧИЕ, заключающееся в том, что межмолекулярные связи НЕ изменяют зарядность!!!
When you open your heart to patriotism, there is no room for prejudice.
- Avak_Avakyan
- Сообщения: 95
- Зарегистрирован: Пн июн 15, 2015 10:08 pm
Re: Спор о фазах, природе химической связи, валентности и степени окисления
Я имею в виду СВЯЗИ, ПРИ РАЗРЫВЕ КОТОРЫХ ПОЛУЧАЮТСЯ РАДИКАЛЫ ИЛИ ИОНЫ. Вот Вам предельно простая и чёткая формулировка, что такое ВАЛЕНТНАЯ связь. Если при разрыве связи получаются ионы или радикалы, — то связь валентная. Если молекулы, к которым ион или радикал «не привинтишь» (как H2O―CH3 и H2O―Na), — значит связь невалентная (то есть межмолекулярная). ЗАРЯДОМ я называю «ту чёрточку», которая «не позволяет привинтить» к воде натрий H2O―Na (ион) или метил H2O―CH3 (радикал).chaus писал(а): ↑Чт май 17, 2018 4:39 pmВот интересно, что изменяет заряд атома, а что не изменяет: связь С-С в этане изменяет ли заряд атома углерода? А связь Fe-C в [Fe(CO)5] изменяет ли заряд атома железа? Если да, то в каком случае насколько? Не надо филологии, дайте ссылку на конкретные результаты измерений.
Можно очень долго обсуждать, что факт наличия самогò электрона ещё достаточно спорный; приводить парадоксы и т.п.. Можно обсуждать разные модели химсвязи от примитивно школьной «дал электрон / принял электрон» до «спаривания
А потому, ещё раз, вот Вам предельно чёткая формулировка: ВАЛЕНТНЫМИ НАЗЫВАЮТСЯ СВЯЗИ, ПРИ РАЗРЫВЕ КОТОРЫХ ПОЛУЧАЮТСЯ РАДИКАЛЫ ИЛИ ИОНЫ. ВСЕ ОСТАЛЬНЫЕ СВЯЗИ — МЕЖМОЛЕКУЛЯРНЫЕ. Это, на самом деле, наиболее лингвистически точное формулирование базовых представлений химии, делящих соединения на «атомные» («валентные») и «межмолекулярные».
Ивана Царевича от ВЗРОСЛЫХ братьев отличает НЕ гениальность, а девственность. Подоночность, серость, тупость и пассивность — это НЕ врождённая бездарность, а НЕРЕСТОВЫЕ изменения, именуемые в мире рыб ЛОШАНИЕМ, а в мире людей СТЕПЕННОСТЬЮ и ВЗРОСЛОСТЬЮ. ©
- Droog_Andrey
- Сообщения: 2670
- Зарегистрирован: Сб сен 29, 2007 8:29 pm
- Контактная информация:
Re: Спор о фазах, природе химической связи, валентности и степени окисления
Прекрасно.
При разрыве N2O2 получается два радикала NO. В этом димере связь валентная?
При разрыве N2O2 получается два радикала NO. В этом димере связь валентная?
2^74207281-1 is prime!
Re: Спор о фазах, природе химической связи, валентности и степени окисления
Да и при разрыве классических координационных связей в нитропруссиде Na2[Fe(CN)5(NO)] получается радикал NO и ионы CN(-) и Fe(3+).
When you open your heart to patriotism, there is no room for prejudice.
Re: Спор о фазах, природе химической связи, валентности и степени окисления
Это феерично!
When you open your heart to patriotism, there is no room for prejudice.
- Avak_Avakyan
- Сообщения: 95
- Зарегистрирован: Пн июн 15, 2015 10:08 pm
• Антихимики Ландау, Лифшиц и IUPAC •
Было: как мы ужè выяснили, эти «образцовые антихимические воззрения» принадлежат Ландау, Лифшицу и являются официальной формулировкой IUPAC. Так что ПОЗДРАВЛЯЮ с переносом их в «антихимию»!!!
N═O — один и спорнейших примеров в химии; дело в том, что он умеет быть и катионом (NO+ClO4−), и анионом (Na+NO−, нитрозилнатрий; см. «Реми Г; Курс неорганической химии; Том 1; 1963; стр. 657»), и ковалентно связанной группой (в нитрозаминах, это самый близкий пример к N2O2), и радикалом, склонным к димеризации, и нейтральной молекулой с двухвалентным азотом, и нейтральным лигандом в комплексах, связанным ван−дер−ваальсово. В свободном виде его «сущность» в первую очередь зависит от температуры: чем она выше — тем больше он принимает облик нейтральной молекулы с реально двухвалентным азотом. Это редкий пример реально двухвалентного азота, и это не исключение, а закономерность; у хлора и даже у марганца мы наблюдаем эту закономерность: нечётные степени окисления устойчивы в кислотах; чётные — в окислах. При попытке дегидратировать HClO3 мы получаем не Cl2O5, а дисмутацию до ClO2 и Cl2O6; зато при их гидролизе опять же происходят дисмутации до кислот с нечётными степенями окисления. У азота сесквиоксид N2O3 ужè выше −101°C начинает дисмутировать на NO и NO2.Droog_Andrey писал(а): ↑Пт май 18, 2018 1:43 pmПри разрыве N2O2 получается два радикала NO. В этом димере связь валентная?
С такими димерами, как N2O2, N2O4 и т.п. в каждом конкретном случае нужно тщательно выяснять; причём при разных ТЕМПЕРАТУРАХ ответ на Ваш вопрос может быть разным (при одних температурах связь может быть как в дигидроле, а при более низких возможна реакция с повышением валентности азота, то есть может возникать валентная связь, подобная связи C―C в щавелевой кислоте)! Общеизвестно, что степень окисления (как и более нехимеричное понятие — число валентных связей) может падать при нагревании: при низких температурах устойчивы богатые кислородом окислы, а при нагревании они поступенно теряют кислород, и это является понижением СТЕПЕНИ ОКИСЛЕНИЯ оксидообразующего элемента. Кроме того, возможны изомеризации; например, N2O4 может иметь облик O2NNO2, а может и NO+NO3−. Является ли димеризация NO повышением числà валентных связей азота, или связь N―N в димере N2O2 ван−дер−ваальсова как в дигидроле? Ответить должны химреакции. В Химэнциклопедии данà интересная информация: «При обычных условиях [NO] быстро окисляется до NO2, с повышением т−ры скорость р−ции уменьшается. Это обусловлено тем, что с О2 взаимод. молекулы димера N2O2, содержание к−рого с повышением т−ры уменьшается.». То, что охотно автоокисляется именно димер N2O2, — это заставляет вспомнить про самовозгорающийся дифосфин H2P―PH2, в котором связь бесспорно валентная, и несамовозгорающийся монофосфин PH3. Кроме того, оксид трёхвалентного азота N2O3 синий, и N2O2 тоже синий. Всё это указывает, что связь N―N в N2O2 валентная, как в дифосфине и нитрозаминах. Продукт его термического распада N═O — действительно радикал, однако чем выше температура — тем более ослабевает обратимая димеризация, и N═O всё в большей степени превращается в соединение двухвалентного азота — нейтральную молекулу.
Получаются молекулы с двухвалентным азотом N═O (в нитропруссидах N═O выступает в роли нейтральной молекулы). И ещё: Вы НЕ путайте, о какой связи речь идёт. Межмолекулярные связи в гексацианоферратах — между молекулами KCN и молекулами Fe(CN)2 или 3, а связи цианид−аниона с металлами — валентные, соответствующие степеням окисления. Вы скажете, что цианогруппы сидят на желèзе? А я спрошу: ПОЧЕМУ ЖЕ при нагревании кровяных солей разлагается только цианид желèза, а цианид калия остаётся жив−здоров, что делает эту реакцию излюбленным способом получения цианистого калия?! Если бы цианогруппы были «собственностью» именно желèза, и все шесть связей желèза с шестью цианогруппами были бы равноценными, — ОБЪЯСНИТЕ, ПОЧЕМУ ЖЕ столь избирательно разлагается ТОЛЬКО цианистое железо, но НЕ разлагается цианистый калий!!! Вот Вы сами своими руками и
Ивана Царевича от ВЗРОСЛЫХ братьев отличает НЕ гениальность, а девственность. Подоночность, серость, тупость и пассивность — это НЕ врождённая бездарность, а НЕРЕСТОВЫЕ изменения, именуемые в мире рыб ЛОШАНИЕМ, а в мире людей СТЕПЕННОСТЬЮ и ВЗРОСЛОСТЬЮ. ©
- Droog_Andrey
- Сообщения: 2670
- Зарегистрирован: Сб сен 29, 2007 8:29 pm
- Контактная информация:
Re: • Антихимики Ландау, Лифшиц и IUPAC •
А вот его строение (при низкой температуре, естественно):
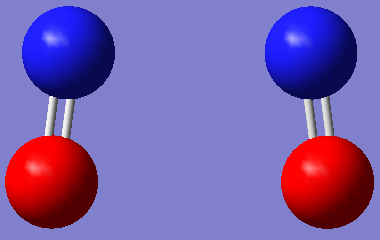
Как поглядишь - ни дать ни взять - типичный ван-дер-ваальсов комплекс
2^74207281-1 is prime!
- Avak_Avakyan
- Сообщения: 95
- Зарегистрирован: Пн июн 15, 2015 10:08 pm
Re: Спор о фазах, природе химической связи, валентности и степени окисления
И кто же его так нарисовал?Droog_Andrey писал(а): ↑Сб май 19, 2018 12:55 amА вот его строение (при низкой температуре, естественно)
https://pubchem.ncbi.nlm.nih.gov/compound/6857661
его нарисовали трижды — вот так:
А на
https://www.molinstincts.com/chemical-s ... 93258.html
даже Вашим любимым 3D−аниматором «JSmol» поиграться можно.
У вас нет необходимых прав для просмотра вложений в этом сообщении.
Ивана Царевича от ВЗРОСЛЫХ братьев отличает НЕ гениальность, а девственность. Подоночность, серость, тупость и пассивность — это НЕ врождённая бездарность, а НЕРЕСТОВЫЕ изменения, именуемые в мире рыб ЛОШАНИЕМ, а в мире людей СТЕПЕННОСТЬЮ и ВЗРОСЛОСТЬЮ. ©
- Droog_Andrey
- Сообщения: 2670
- Зарегистрирован: Сб сен 29, 2007 8:29 pm
- Контактная информация:
Re: Спор о фазах, природе химической связи, валентности и степени окисления
Природа его такова.
Это его экспериментально определённое строение.
2^74207281-1 is prime!
- Avak_Avakyan
- Сообщения: 95
- Зарегистрирован: Пн июн 15, 2015 10:08 pm
Re: Спор о фазах, природе химической связи, валентности и степени окисления
Ссылку приведите. По мною данным ссылкам разве не «его экспериментально определённое строение»? 
Эй, батенька; а ведь Ваша картинка:
http://www.primefan.ru/stuff/chem/n2o2.png
находится на музыкальном сайте:
http://www.primefan.ru/
Это Ваш сайт? Вы эту картинку сами в Windows Paint нарисовали?
Вы эту картинку сами в Windows Paint нарисовали? 

Я Вам привёл ссылку на структуру N2O2 из «PubChem Compounds» — одной из главных мировых баз как раз экспериментально определённых структур, а Вы в ответ дурака валяете и фейк подсовываете?
Эту структуру в онлайн визуализаторе можете посмотреть по ссылке:
http://molview.org/?cid=6857661
6857661 — это номер O═N―N═O в базе «PubChem Compounds» (с которой он и загрузится). В открывшейся странице нажмите «Close». Увидите модель аниматора «GLmol». Она примитивная; советую нажать наверху «Model» и в выпавшем меню поставить галочку у «Jmol» вместо «GLmol». После этого изображение справа можно будет покрутить мышкой. Выглядит оно вот так: Есть и ещё один ресурс:
http://www.ebi.ac.uk/chebi/chebiOntolog ... HEBI:29797
Там дают скачать (нажмите) .mol и .sdf файлы. Если на Вашем компе их нечем открыть — откройте онлайн визуализатор:
https://blokhin.github.io/cif-js-engines/
В нём нажмите «Обзор…» и откройте скачанный файл; затем наверху нажмите «JSmol». Опять же результат можно будет покрутить мышкой.
P.S. Вот тàк вот с антихимиками…
Эй, батенька; а ведь Ваша картинка:
http://www.primefan.ru/stuff/chem/n2o2.png
находится на музыкальном сайте:
http://www.primefan.ru/
Это Ваш сайт?
Я Вам привёл ссылку на структуру N2O2 из «PubChem Compounds» — одной из главных мировых баз как раз экспериментально определённых структур, а Вы в ответ дурака валяете и фейк подсовываете?

Эту структуру в онлайн визуализаторе можете посмотреть по ссылке:
http://molview.org/?cid=6857661
6857661 — это номер O═N―N═O в базе «PubChem Compounds» (с которой он и загрузится). В открывшейся странице нажмите «Close». Увидите модель аниматора «GLmol». Она примитивная; советую нажать наверху «Model» и в выпавшем меню поставить галочку у «Jmol» вместо «GLmol». После этого изображение справа можно будет покрутить мышкой. Выглядит оно вот так: Есть и ещё один ресурс:
http://www.ebi.ac.uk/chebi/chebiOntolog ... HEBI:29797
Там дают скачать (нажмите) .mol и .sdf файлы. Если на Вашем компе их нечем открыть — откройте онлайн визуализатор:
https://blokhin.github.io/cif-js-engines/
В нём нажмите «Обзор…» и откройте скачанный файл; затем наверху нажмите «JSmol». Опять же результат можно будет покрутить мышкой.
P.S. Вот тàк вот с антихимиками…
У вас нет необходимых прав для просмотра вложений в этом сообщении.
Ивана Царевича от ВЗРОСЛЫХ братьев отличает НЕ гениальность, а девственность. Подоночность, серость, тупость и пассивность — это НЕ врождённая бездарность, а НЕРЕСТОВЫЕ изменения, именуемые в мире рыб ЛОШАНИЕМ, а в мире людей СТЕПЕННОСТЬЮ и ВЗРОСЛОСТЬЮ. ©
Re: • Антихимики Ландау, Лифшиц и IUPAC •
Сгораю от нетерпения узнать: в какой работе Ландау и/или Лифшица сказано, чтоAvak_Avakyan писал(а): ↑Пт май 18, 2018 10:03 pmБыло: как мы ужè выяснили, эти «образцовые антихимические воззрения» принадлежат Ландау, Лифшицу и являются официальной формулировкой IUPAC.
When you open your heart to patriotism, there is no room for prejudice.
- Avak_Avakyan
- Сообщения: 95
- Зарегистрирован: Пн июн 15, 2015 10:08 pm
Re: Спор о фазах, природе химической связи, валентности и степени окисления
Ах, Вы об этом.Avak_Avakyan писал(а): ↑Пт май 18, 2018 1:40 pmфакт наличия самогò электрона ещё достаточно спорный
А я сгораю от нетерпения услышать Ваш ответ на мой вопрос, который Вы проигнорировали:
Avak_Avakyan писал(а): ↑Пт май 18, 2018 10:03 pmВы скажете, что цианогруппы сидят на желèзе? А я спрошу: ПОЧЕМУ ЖЕ при нагревании кровяных солей разлагается только цианид желèза, а цианид калия остаётся жив−здоров, что делает эту реакцию излюбленным способом получения цианистого калия?! Если бы цианогруппы были «собственностью» именно желèза, и все шесть связей желèза с шестью цианогруппами были бы равноценными, — ОБЪЯСНИТЕ, ПОЧЕМУ ЖЕ столь избирательно разлагается ТОЛЬКО цианистое железо, но НЕ разлагается цианистый калий!!!
Ивана Царевича от ВЗРОСЛЫХ братьев отличает НЕ гениальность, а девственность. Подоночность, серость, тупость и пассивность — это НЕ врождённая бездарность, а НЕРЕСТОВЫЕ изменения, именуемые в мире рыб ЛОШАНИЕМ, а в мире людей СТЕПЕННОСТЬЮ и ВЗРОСЛОСТЬЮ. ©
Re: Спор о фазах, природе химической связи, валентности и степени окисления
Огорчу Вас: нет физиков, проводящих такие эксперименты. И не было. Такие дела.Avak_Avakyan писал(а): ↑Пн май 21, 2018 11:51 amЕсть мудрые физики, ставящие эксперименты с двумя щелями и пропускающие через них электрон; делающие подобные эксперименты со всё более интересными вариациями… Эти эксперименты с двумя щелями проводят те, кто НЕ ВЕРУЮТ, а пытаются выяснить: есть ли электрон, а если есть, то какой он.
Электронная дифракция как явление давно является инструментом исследований, почти уже рутинных, в результате которых установлено (причём достоверно) строение кристаллов и природа химической связи. Кстати, на этом форуме есть химики, проводившие именно такие исследования собственноручно.
У древних греков был такой софизм: "Если ты чего-нибудь не терял, то ты это имеешь. Ты не терял рогов, значит, ты рогатый".Avak_Avakyan писал(а): ↑Пн май 21, 2018 11:51 amu]ОБЪЯСНИТЕ, ПОЧЕМУ ЖЕ столь избирательно разлагается ТОЛЬКО цианистое железо, но НЕ разлагается цианистый калий[/u]!!!
Но дело-то в том, что мало "не терять" или "не разлагаться". Надо ещё, чтобы этот предмет был изначально. А в гексацианоферратах нет ни цианистого железа, ни цианистого калия. (Сомневаетесь -- попробуйте гексацианоферат на вкус.) На самом деле, если при химической реакции получается какое-либо вещество, это не значит, что оно было в каком-то "замаскированном виде" в прекурсорах. Нет, химические реакции -- это превращение одних веществ в другие вследствие разрыва химических связей и образования новых. В частности, при термическом разложении гексацианоферрата калия образуются, как промежуточные частицы: ионы калия, цианид-ионы, карбид железа (кстати, что там со степенью окисления железа?), азот. Что с чем может соединиться? Наиболее логично предположить, что ионы калия соединятся с цианид-ионами. Но на самом деле выход цианида по этой реакции низкий, и при необходимости цианистый калий в лаборатории получают совсем другим способом и из другого прекурсора.
Именно по этой причине химические реакции и не позволяют достоверно установить строение вещества: прежние связи рвутся, новые образуются. Поэтому для установления строения вещества используются более надёжные методы.
When you open your heart to patriotism, there is no room for prejudice.
- Droog_Andrey
- Сообщения: 2670
- Зарегистрирован: Сб сен 29, 2007 8:29 pm
- Контактная информация:
Re: Спор о фазах, природе химической связи, валентности и степени окисления
При желании в два клика можно доказать, что приведённая мной структура соответствует реальности. Но Вам это, конечно же, не надо.
2^74207281-1 is prime!
- Avak_Avakyan
- Сообщения: 95
- Зарегистрирован: Пн июн 15, 2015 10:08 pm
Re: Спор о фазах, природе химической связи, валентности и степени окисления
Обрадую Вас, — есть!
Ага; поэтому дигидроль — это не H2O, а O2H4, и он не содержит в себе H2O в замаскированном виде. И кристалл поваренной сòли — это не NaCl, потому что это кристалл и в нём совершенно другие химические связи…chaus писал(а): ↑Пн май 21, 2018 12:29 pmНа самом деле, если при химической реакции получается какое-либо вещество, это не значит, что оно было в каком-то "замаскированном виде" в прекурсорах. Нет, химические реакции -- это превращение одних веществ в другие вследствие разрыва химических связей и образования новых.
Ага; я вот пробую на вкус кристаллы твёрдого раствора NH4F со льдом, и по вкусу заключаю, что никакой воды в этих кристаллах нет…
А это зависит от того, как эту реакцию проводить: на воздухе выход KCN будет одним, в пламени — другим, в инертной атмосфере — третьим, а в вакууме — четвёртым. И от температуры и скорости нагрева выход тоже зависит.
Цементит — клатрат; валентных связей желèза с углеродом в нём нет, я об этом ужè говорил. На самом деле, при пиролизе многие комплексы (и не комплексы) разлагаются радикально до продуктов, напоминающих об исходном соединении только элементным составом. Однако Вы в упор не хотите заметить, что пиролиз гексацианоферратов, так же, как и их разложение крепкой серной кислотой, являет нам ДВУХВАЛЕНТНОСТЬ желèза в жёлтой и ТРЁХВАЛЕНТНОСТЬ в красной кровяных солях. Калия там не случайно оказывается нужное количество для образования именно такого количества KCN: количество калия в комплексе жёстко диктуется ВАЛЕНТНОСТЬЮ желèза. О да: я имею в виду «стехиометрическую валентность».chaus писал(а): ↑Пн май 21, 2018 12:29 pmВ частности, при термическом разложении гексацианоферрата калия образуются, как промежуточные частицы: ионы калия, цианид-ионы, карбид железа (кстати, что там со степенью окисления железа?), азот. Что с чем может соединиться? Наиболее логично предположить, что ионы калия соединятся с цианид-ионами.
А главная разница между комплексной (межмолекулярной) и валентной связями — это разница между дигидролем и перекисью. КАК МОЖНО столько страниц исписывать, не понимая эту разницу?! Между дибораном−6 (B2H6) и дибораном−4 (B2H4) разница та же, что между дигидролем и перекисью. Прочность продукта может быть разной и в мире ассоциатов, и в мире валентных соединений. Однако связи, выходящие за рамки «стехиометрической валентности», имеют иную природу.
На самом деле, чтобы узнать реальное положение дел, а не то, как кто что нарисовал и анимировал, предлагаю глянуть на ещё один процесс, описанный в этой книжке (ссылка), — реакцию N2O2 с водородом:Droog_Andrey писал(а): ↑Пн май 21, 2018 3:08 pmПри желании в два клика можно доказать, что приведённая мной структура соответствует реальности. Но Вам это, конечно же, не надо.
2NO ⇄ N2O2;
N2O2 + H2 → N2O + H2O;
N2O + H2 → N2 + H2O.
То, что в реакцию с водородом вступает именно димер, а результатом оказывается СОХРАНЕНИЕ связи азот−азот, можно интерпретировать как очередное доказательство, что эта связь азот−азот есть в исходном N2O2, и что она подобна связи в нитрозаминах (т.е. валентная), а не в дигидроле.
В случае с N2O2 Ваши словà весьма уместны: связь хлипкая, димеризация обратимая, интермедиаты ещё нужно надёжно «засечь» (и ещё надо надёжно «засечь», где реагирует именно димер, а не мономер, ион или радикал). Но это просто означает, что нужно разными реакциями получить доказательства. Те реакции с N2O2, что я цитирую, я сам НЕ проводил; то есть это книжная информация (и, следовательно, спорная).
СПАСИБО Гессу за информативную ссылку: по данному запросу я нашёл «воду на мою мЫльницу».
Ивана Царевича от ВЗРОСЛЫХ братьев отличает НЕ гениальность, а девственность. Подоночность, серость, тупость и пассивность — это НЕ врождённая бездарность, а НЕРЕСТОВЫЕ изменения, именуемые в мире рыб ЛОШАНИЕМ, а в мире людей СТЕПЕННОСТЬЮ и ВЗРОСЛОСТЬЮ. ©
Кто сейчас на конференции
Сейчас этот форум просматривают: Google [Bot] и 22 гостя